抗疟研究新进展!颜宁团队和尹航团队聚焦糖转运蛋白“饿死疟原虫”
2020年8月28日,原清华大学生命科学学院、医学院、现普林斯顿大学分子生物学系颜宁团队和清华大学药学院尹航团队合作在国际顶级期刊《细胞》上在线发表题为《抑制恶性疟原虫糖摄入的结构基础》(Structural Basis for Blocking Sugar Uptake into the Malaria Parasite Plasmodium falciparum)的重要研究成果。
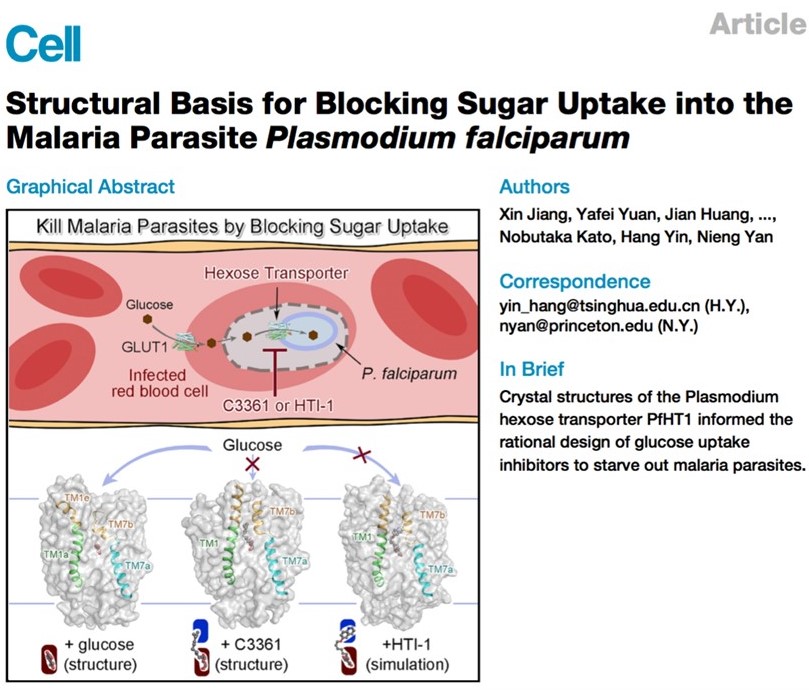
该论文阐释了己糖转运蛋白PfHT1(Plasmodium falciparum hexose transporter 1)分别结合天然底物葡萄糖和一个已知的选择性与抑制效果均较弱的抑制剂C3361的两个结构。出乎意料,C3361的结合导致了PfHT1巨大的构象变化,衍生出一个全新的空腔结构,可以被作为靶点进行抑制剂的设计与优化。在此发现的基础上,团队成员开发出了一系列具有更高亲和力的选择性抑制剂,在原虫抑制实验中确认可以有效杀死疟原虫,却对人源细胞无害,从而为开发新一代抗疟药物开辟了道路。
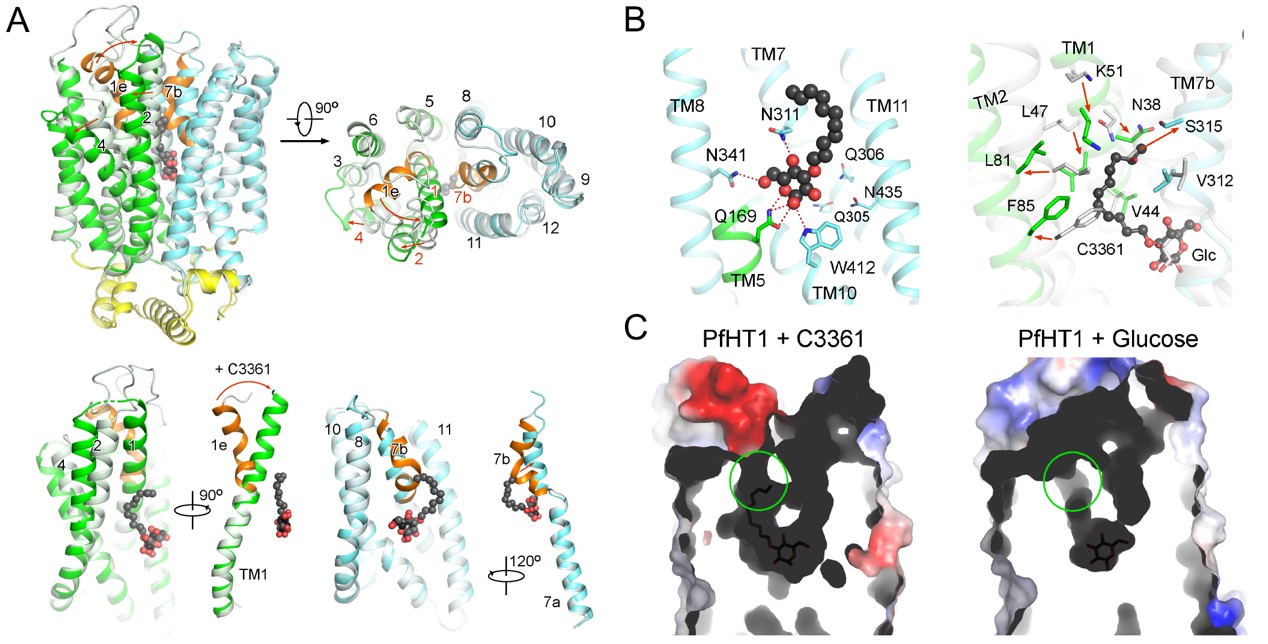
C3361别构抑制PfHT1并诱导产生新的空腔结构
(A)相比与底物葡萄糖结合的PfHT1蛋白构象,与抑制剂C3361的结合引起了PfHT1蛋白巨大的构象变化;
(B)C3361分子在占据底物葡萄糖结合位点的同时在其尾部诱导产生了一个新的空腔;
(C)葡萄糖/C3361分别与PfHT1结合构象下的空腔对比
一、采用新思路,饿死疟原虫
疟疾(Malaria)是疟原虫(Plasmodium)通过雌性按蚊为媒介传播的传染性疾病,是当今世界公共卫生的突出问题。可寄生于人类的疟原虫有5种,包括:恶性疟原虫(Plasmodium falciparum)、卵形疟原虫(Plasmodium ovale)、间日疟原虫(Plasmodium vivax)、三日疟原虫(Plasmodium malariae)和诺氏疟原虫(Plasmodium knowlesi),其中恶性疟原虫可感染各个时期的红细胞,引起严重的全身症状甚至导致死亡,是现存对人类健康威胁最大的疟原虫。当前,全球抗击疟疾的难题是疟原虫开始对现有药物治疗方法产生耐药性,过去行得通的方法在逐渐失去效力。如何开拓思路发现新的抗疟方法,是科学家们关注的重点。
“饿死疟原虫”研究,可分为三个阶段的突破。
阶段1:找到致命弱点
葡萄糖是大多数动物细胞的主要能源物质,通过抑制细胞摄取葡萄糖的“饥饿疗法”,可作为治疗一些相关疾病的潜在治疗策略。PfHT1是恶性疟原虫主要的葡萄糖摄入蛋白。通过抑制该蛋白的转运活性,将可能有效抑制疟原虫的能量摄入从而抑制其生长和增殖,但是该策略的难度在于如何定向抑制疟原虫的糖摄入而不影响人体细胞。
阶段2:找到杀手锏
在早期针对PfHT1作为抗疟靶点的研究中,由于缺乏该蛋白的结构信息,特别是结合抑制剂状态下的复合物结构信息,抑制剂的开发工作没有取得突破性进步。原清华大学生命科学学院教授颜宁领导的团队率先将目标锁定PfHT1,并在结构解析的基础上与清华大学药学院尹航教授团队合作进行基于结构的小分子药物开发,并成功获得了一系列具有更高亲和力与选择性的靶向PfHT1的小分子抑制剂。
阶段3:确保安全
为了确认尹教授团队设计的抑制剂杀死了疟原虫而非人类细胞,全球健康药物研发中心(GHDDI)为此提供了大力支持。GHDDI作为非营利性新药研发机构,专注于全球健康相关疾病的药物研发,疟疾正是GHDDI的重点研究领域之一,并对此拥有相关多年研发经验的人才储备。尹教授团队将该抑制剂交由GHDDI的疟疾疾病生物学小组负责人加藤信高(Nobutaka Kato)博士,该团队在不同浓度葡萄糖的培养基中培养耐药性疟原虫,分别给予该抑制剂,并进行梯度剂量测试。结果证实,该抑制剂可有效阻断PfHT1摄入葡萄糖,疟原虫因无法利用葡萄糖产生能量而死亡。该抑制剂与青蒿素一样迅速有效,且几乎没有对人类细胞产生副作用。
二、为新一代抗疟药物奠定基础
上世纪七十年代,屠呦呦等中国科技工作者从黄花蒿中成功提取出抗疟效果良好的青蒿素化合物。至今以青蒿素为基础的药物联用疗法(Artemisinin-based combination therapy,ACT)仍旧是治疗恶性和重症疟疾的一线疗法,对全球的抗疟工作起到了突出贡献,屠呦呦也因此获得2015年诺贝尔生理与医学奖。然而由于耐药性疟原虫的产生,ACT疗法已先后在东南亚和非洲地区出现了治疗失败的病例,开发新型抗疟药物已成为亟需解决的重要科学和公共卫生问题。
清华大学药学院院长、全球健康药物研发中心(GHDDI)主任丁胜表示, “随着近几年疟疾在中国的销声匿迹,这一曾经深深困扰国人的疾病逐渐淡出大众的视野。然而,在撒哈拉以南的非洲仍有数百万人深受其害。耐药疟原虫的出现、治疗药物的失效,也不断警醒着我们——抗疟新药研发工作刻不容缓。如今,颜宁、尹航等多个团队通过紧密合作,协同海内外多位科学家,通过抑制疟原虫对葡萄糖的摄取 “饿死疟原虫”,并创新性地发现有效及安全的抑制剂,代表着一种新型抗疟药物研发思路。”
与此同时,生物领域预印本平台bioRxiv上发表了该合作团队题为《靶向PfHT1蛋白正构-别构双位点的选择性抗疟药物开发》(Orthosteric-allosteric dual inhibitors of PfHT1 as selective anti-malarial agents)的研究成果。该文章进一步详细阐明了新一代小分子抑制剂系列的设计思路和构效关系,并通过一系列的原虫抑制实验验证了该系列小分子抑制剂的高杀伤性、低细胞毒性以及针对原虫多个繁殖周期都具有良好抑制效果的多周期性。
中国科学院院士、清华大学饶子和教授表示:“研究团队以阻断疟原虫能源摄取为新手段开发的新一代化合物有望解决日趋严重的疟疾耐药性问题;同时靶向膜转运蛋白的正构及别构调节位点的抑制剂设计思路非常具有创造性,也为其他药物理性设计提供了参考。”
综上,研究团队针对疟疾耐药性不断增加的现状,通过对底物或抑制剂结合状态下的PfHT1蛋白结构解析,鉴定了新的药物结合位点并设计出一系列高效的“正构-别构”双位点抑制剂。通过抑制疟原虫对葡萄糖的摄取,从而“饿死疟原虫”,这代表着一种新型抗疟药物研发方向的出现,为下一代抗疟药物的研发奠定了基础。
文章的共同通讯作者为原清华大学生命科学学院、医学院、现普林斯顿大学分子生物学系教授颜宁和清华大学药学院教授尹航,共同第一作者为现已毕业的清华大学生命科学学院博士蒋鑫、清华大学生命科学学院博士后袁亚飞、清华大学化学系2016级博士生黄健与清华大学生命科学学院2017级博士生张硕。
本研究历时多年,在此过程中经费来源于清华大学结构生物学高精尖创新中心、生物联合中心、膜生物学国家重点实验室、国家自然科学基金与北京高校卓越青年科学家计划项目的支持。实验得到全球健康药物研发中心(GHDDI)疟疾项目团队、日本SPring-8同步辐射中心、上海同步辐射光源(SSRF)、以及清华大学蛋白质研究技术中心X射线晶体学平台以及清华大学药学技术中心的支持。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(20)31006-0#


